5 de diciembre de 2008
Los envases y embalajes
Ecoembes
Anfevi (Asociación Nacional de Fabricantes de Envases de Vidrio)
Vídeo acerca de la fabricación de bolsas de plástico:
El corcho
Sus particularidades se conocían ya hace siglos, aunque se destinaba a la fabricación de productos para la pesca o como material modesto para la construcción. Adquiriría mayor valor en el siglo XVII cuando, tras la creación del champán por Dom Perignon, se buscó un elemento que conservara la bebida en óptimas condiciones. Así comenzó su expansión en el mercado de los tapones para vinos y espumosos, aunque se ha extendido a otras aplicaciones como la construcción y decoración.
Propiedades y productos: La primera capa que se extrae, aproximadamente cuando el árbol tiene unos quince años, es el llamado corcho bornizo. La calidad aumenta progresivamente en las sucesivas extracciones, por lo que el bornizo no se utiliza en la fabricación de tapones, sino sólo para aglomerados para la construcción. El corcho se retira del árbol una vez cada década, aproximadamente.
La versatilidad de este material proviene de sus características. Gracias a la alta proporción de aire que contiene, su densidad es muy baja y, por tanto, muy ligero. Asimismo, la suberina, que es la sustancia que se produce en la transformación de la celulosa, lo convierte en impermeable tanto a gases como a líquidos, y lo hace maleable y resistente; no se deforma fácilmente.
Además, es un excelente aislante tanto térmico como acústico, que lo hace ideal para convertirse en revestimiento de paredes de hospitales, salas de música, etc. En la construcción se utiliza en forma de paneles, elaborados con corcho prensado. Otras peculiaridades que lo complementan es que es inodoro, higiénico y su combustión no es habitual.
Otras aplicaciones más básicas son la fabricación de pizarras para pinchar anotaciones o la fabricación de maquetas.
El reciclado del papel y del cartón
 1/ Gestión Forestal Sostenible: Los bosques cultivados en España representan 400.000 hectáreas y absorben 10 toneladas de CO2 por hectárea cada año. Gracias a una gestión forestal sostenible, el sector papelero contribuye al incremento de la superficie arbolada y al desarrollo rural, creando empleo y riqueza.
1/ Gestión Forestal Sostenible: Los bosques cultivados en España representan 400.000 hectáreas y absorben 10 toneladas de CO2 por hectárea cada año. Gracias a una gestión forestal sostenible, el sector papelero contribuye al incremento de la superficie arbolada y al desarrollo rural, creando empleo y riqueza.Por su parte, durante 2007, los españoles recuperamos casi 5 millones de toneladas de papel usado, lo que supone un aumento de 5,9 % sobre las cifras de recogida aparente del año anterior. La tasa de utilización se sitúa en el 84,6% y la de reciclaje en el 73,7%. Esto significa que ahorramos un 1 % de las emisiones de dióxido de carbono generadas en el país.
6/ Bobinas de papel: La materia prima con que se fabrica el cartón ondulado es el papel. A su vez, la materia prima para la fabricación del papel es la celulosa que se obtiene de la madera (fibra virgen), del papel recuperado y de fibras vegetales anuales, como la paja de cereales (fibra reciclada).Papel de fibra virgen: 15%Papel de fibra reciclada: 85%
7/ Planchas de cartón ondulado: La producción de cartón ondulado en España durante 2007 alcanzó los 4.638 millones de metros cuadrados, lo que supone un incremento del 0,65 % con respecto a las cifras obtenidas en 2006 (4.608 millones de metros cuadrados). El consumo de papel en onduladora ascendió a 2,8 millones de toneladas.
8/ Cajas de cartón ondulado: La media de consumo de cartón ondulado por habitante y año se cifró en los 55,93 kilogramos durante 2007. Esto significa que un consumidor entra en contacto con 10 o 20 embalajes distintos de cartón ondulado cada día.
9/ Cajas de cartón con productos: Los principales sectores demandantes de envases de cartón ondulado son los productos agrícolas y alimenticios, con el 23% y el 16,5% del total respectivamente. Le siguen las bebidas, con el 15%, y la transformación del cartón ondulado, con el 13,2%.
10/ Cajas usadas listas para reciclar: Todo producto de cartón ondulado que vaya identificado por el Sello RECIPAP es reciclable. El cartón usado se puede volver a utilizar, convirtiéndolo en materia prima secundaria. Su recuperación permite que se integre nuevamente en el ciclo productivo como fibra reciclada. Y cuando no es apto para el reciclaje se valoriza energéticamente, utilizándose como biocombustible, o se utiliza para hacer compost, por ser fácilmente biodegradable.
El papel y el cartón
.png)
Reciclapapel: página web del Departamento de Medio Ambiente del Gobierno de Aragón, donde se puede obtener mucha información: rastrea en sus diferentes secciones.
Papelnet: página web de Chile donde se relacionan la industria forestal, la celulosa, el papel y los correspondientes procesos productivos
Página Urbano Ambiental: página desarrollada por Manuel Jódar, con un apartado dedicado al papel.
Wikipedia
Enciclopedia Encarta
La madera (II): vídeos
Y también este otro acerca del proceso de fabricación de una puerta de madera:
La madera
.png) La madera es la materia prima que más ha explotado el hombre desde la antigüedad. Desde siempre, sus usos han sido muy variados: como combustible (leña), como elemento estructural para la construcción, como fuente de pulpa de celulosa (para fabricar el papel y el cartón), como material para fabricar utensilios y herramientas manuales, objetos decorativos, etc...
La madera es la materia prima que más ha explotado el hombre desde la antigüedad. Desde siempre, sus usos han sido muy variados: como combustible (leña), como elemento estructural para la construcción, como fuente de pulpa de celulosa (para fabricar el papel y el cartón), como material para fabricar utensilios y herramientas manuales, objetos decorativos, etc...Haz clic sobre la imagen de la derecha para ver con más detalle una lámina publicada en AULA 2 (El Mundo).
Los siguientes enlaces conducen a páginas donde hay gran cantidad de información acerca de las clases de madera que hay, de sus propiedades, y de los procesos de obtención, de transformación y acabado...
- Wikipedia
- TecnoWeb
- Talla en Madera 1: Generalidades sobre la madera
- Talla en Madera 2: Anatomía del árbol
- Talla en Madera 3: Las plagas de la madera
- Talla en Madera 4: Secado y almacenado
- Talla en Madera 5: Clases de madera
- Guía de las Maderas
- AITIM (Asociación Técnica de Investigación de Industrias de la Madera)
- FEIM (Federación Española de Industrias de la Madera)
- ASERMA (Asociación Española de Recuperadores de Madera)
Aplicaciones del acero: ferralla para el hormigón armado
4 de diciembre de 2008
Un metal resistente: el titanio (Ti)
 Su mineral más común es el rutilo, dióxido de titanio cristalizado y de la ilmenita formada por titanio y hierro.
Su mineral más común es el rutilo, dióxido de titanio cristalizado y de la ilmenita formada por titanio y hierro.PROCESO DE OBTENCIÓN
La cloruración es la transformación de óxido de tetracloruro de titanio a temperatura elevada. Una vez condensado y purificado es reducido en un reactor y se obtiene la esponja de titanio. Después se funde y se obtienen los lingotes de metal.
Metal de color blanco plateado, brillante, ligero, muy duro y de gran resistencia mecánica. Se oxida y es atacado por los ácidos fuertes pero soporta los agentes atmosféricos.
Un metal líquido: el mercurio (Hg)
PROCESO DE OBTENCIÓN
Se somete a un proceso de tostación en presencia de aire. El mercurio se volatiliza y sus vapores son conducidos a dispositivos de condensación, donde el mercurio se condensa y se recoge en estado líquido.
CARACTERÍSTICAS
Líquido de color plateado y brillante de densidad elevada, buen conductor de la electricidad y elevado coeficiente de dilatación térmica. Disuelve casi todos los demás metales, excepto el hierro, el níquel, el molibedno y tungteno. Con estos forma amalgamas.
APLICACIONES DEL MERCURIO
Se fabrican termómetros y barómetros por su temperatura uniforme. Las amalgamas se utilizan como empaste de dientes. Se emplea para fabricar lámpara fluorescentes y pilas de botón. Es venenoso, su intoxicación se denomina hidrargirismo. El organismo no es capaz de eliminarlo.
Un metal infusible: el volframio (W)
PROCESO DE OBTENCIÓN
Se funden los minerales con carbonato de sodio, para obtener una sal soluble que contiene volframio. Se trata con ácido clorhídrico para obtener óxido de volframio que precipita en el fondo. Se reduce el óxido por medio de una corriente de hidrógeno en un horno eléctrico.
CARACTERÍSTICAS
De color gris acerado, muy duro y pesado y de buena conductividad eléctrica. Difícil de mecanizar. Es muy dúctil pero para obtener hilos necesitas hileras de diamante. Tiene el punto de fusión más alto de todos los metales.
APLICACIONES DEL VOLFRAMIO
Se utiliza para fabricar filamentos de lámpara de incandescencia y resistencias de hornos eléctricos por su ductilidad, conductividad eléctrica y elevado punto de fusión. Su aleación con carbono se llama carburo de volframio y es usdao para fabricar herramientas de corte y matrices. Se mezcla con cromo, níquel y cobalto para obtener aceros imantados. Se asocia con el titanio y el tántalo para fabricar herramientas de corte rápido.
Un metal blando: el estaño (Sn)
Se extrae básicamente de la casiterita, que es un óxido de estaño pero su riqueza en estaño es muy baja.
PROCESO DE OBTENCIÓN
Es necesario concentrarlo por su baja riqueza. Para ello se tritura y se lava.
Después se somete a un proceso de tostación para eliminar los sulfuros. A continuación se reduce en un horno de reverbero, usando antracita. Se moldea en bloques.
El proceso de afino se lleva a cabo en una cuba electrólitica, el ánodo está formado por planchas de estaño bruto y el cátodo por láminas de estaño puro.
CARACTERÍSTICAS.
De color blanco brillante, muy blando de estructura cristalina, poco dúctil pero maleable. Su estructura cristalina se pone de manifiesto al doblar una barra ya que se escucha el rozamiento de cristales entre si. Puede ser laminado, es estable y resistente a los agentes atmosféricos pero puede ser atacado por ácidos y productos alcalinos.
APLICACIONES DEL ESTAÑO
El papel de estaño no se utiliza por su elevado coste. Se usa para recubrimiento electrolítico de otros metales por su resistencia a la oxidación. Es un elemento imprescindible en las aleaciones:
- Bronces: proporción inferior al 25%
- Metal blando: Se utiliza en la fabricación de cojinetes.
- Aleaciones fusibles y soldadura blanda: Formada a base de estaño y plomo.
Un metal duro: el cromo (Cr)
PROCESO DE OBTENCIÓN
Se utiliza el método Goldschmigt, que consiste en reducir la cromita por tostación usando aluminio en polvo. Así conseguimos ferrocromo.
Después se somete a un afino alectrolítico partiendo un ánodo de plomo.
CARACTERÍSTICAS
De color blanco brillante, muy duro, frágil y estructura cristalina. Esmuy resistente a la oxidación y a la corrosión.
APLICACIONES DEL CROMO
Se emplea para el cromado, recubrimiento electrolítico de otros metales, por su resistencia a la corrosión. Como esta capa es muy porosa y quebradiza se deposita antes una de níquel o cobre.
Acero al cromo: Se fabrican cigüeñales y rodamientos, blindajes y maquinaria de corte. Es un acero inoxidable y sus compuestos se usan para obtener pigmentos colorantes.
Un metal protector: el cinc (Zn)

PROCESO DE OBTENCIÓN
Es similar al del plomo. Se obtiene por vía seca. En la fase de tostación se obtiene el óxido de cinc, después se reduce el óxido en un cromo de retortura con ayuda del carbón y puede afinarse por procedimientos electrolíticos.
La vía húmeda consiste en tratar el mineral triturado con una disolución de ácido sulfúrico. El cinc se disuelve en forma de sulfato de cinc y las impurezas precipitan. Después se trata la disolución con métodos electrolíticos para recuperar el cinc.
De color azulado, brillante, frágil en frío y relativamente blando.
El aire húmedo lo oxida y hace que pierda su brillo. La capa de óxido que lo acompaña lo protege de una oxidación más profunda. No resiste la acción de los ácidos ni de los agentes alcalinos.
APLICACIONES DEL CINC
- Galvanizado electrolítico: Se consigue recubrir las piezas con una delgada capa de cinc que las protege de la corrosión. Es costoso por el consumo eléctrico.
- Galvanizado en caliente: Consiste en sumergir las piezas en un baño de cinc fundido. Se emplea este procedimiento para proteger las estructuras que han de quedar a la intemperie como semáforos, vallas... Es de menor coste.
Un metal inoxidable: el níquel (Ni)
 Era conocido en la antigüedad pero su aprovechamiento industrial se produjo a partir del S.XIX.
Era conocido en la antigüedad pero su aprovechamiento industrial se produjo a partir del S.XIX.La mena del níquel es la niquelina mezcla de sulfuros de hierro, níquel y cobre y la garnierita un silicato hidratado de níqul y magnesio. Su riqueza es del 6%.
- Alto porcentaje en níquel: hasta un 80%. Son el nicrom usado para fabricar resistencias electricas por su resisterncia y el invar usado en relojería.
- Bajo contenido en níquel: No supera el 15%. Se suele alear con hierro y acero para mejorar sus características y facilitar los tratamientos de templado.
Un metal ultraligero: el magnesio (Mg)
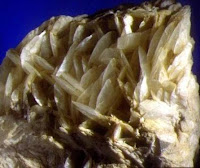 Sus compuestos más comunes son silicatos de magnesio y cloruros de magnesio.
Sus compuestos más comunes son silicatos de magnesio y cloruros de magnesio.PROCESO DE OBTENCIÓN
Se obtiene por dos procedimientos: tratamiento térmico y electrólisis. El tratamiento térmico consiste en someterlos a elevadas temperaturas en un horno eléctrico junto con agentes reductores de oxígeno. Así se libera el magnesio metálico. La electrólisis se aplica al cloruro de magnesio fundido, se coloca en una cuba que hace de cátodo y se introduce una barra de carbón que hace de ánodo. El magnesio liberado en estado de fusión, como es menos denso que el cloruro queda flotando, se retira por medio de la cuchara y se vierte en moldes.
CARACTERÍSTICAS
De color blanco brillante, ligero, blando, maleable y poco dútil. La humedad lo corroe. Tiene gran afinidad por el oxígeno y reacciona rápidamente cuando está pulverizado.
APLICACIONES DEL MAGNESIO
Se emplea en lámparas relámpago y en pirotecnia por su combustión casi explosiva. Se usa como reductor para obtener otros metales. Forma aleaciones ultraligeras por su densidad extraordinariamente baja. Se utilizan en la fabricación de bicicletas, automóviles y motocicletas de competición. Según su composición la aleaciones se clasifican en: aleaciones para fundición y aleaciones para forja.
Un metal ligero: el aluminio (Al)
 Es uno de los elementos metálicos más abundantes de la corteza terrestre(8,13%).
Es uno de los elementos metálicos más abundantes de la corteza terrestre(8,13%).La única mena del aluminio es la bauxita, que es un óxido hidratado de aluminio mezclado con óxido de hierro y otros materiales. Puede llegar a contener un 65% de riqueza.
PROCESO DE OBTENCIÓN
Para obtener aluminio se utiliza el método de Bayer que consta de dos fases: la obtención de la alúmina y el afino electrolítico.
- Obtención de la alúmina: Se convierte en polvo la bauxita mediante un proceso de molienda. Después se mezcla con cal,sosa cáustica y vapor de agua sobrecalentado, de este modo se produce una disolución. Se eliminan las impurezas por decantación. A continuación se añade agua a la disolución para provocar la precipitación del óxido de aluminio y separarlo de la sosa. El producto obtenido es la alúmina, que se somete a un proceso de calcinación para eliminar el exceso de agua.
- Afino electrolítico: La alúmina se funde con criolita y se somete a un proceso electrolítico que separa el aluminio del oxígeno. El oxígeno forna monóxido y dióxido de carbono y se desprende mientras el aluminio puro va depositándose en el fondo de la cuba, de la que se extrae por medio de una cuchara. Este proceso consume mucha energía.
CARACTERÍSTICAS
Es un metal plateado, blando, de baja densidad, su conductividad eléctrica es alta, es muy dúctil y maleable. Puede ser laminado en frío o en caliente y se obtienen tubos, barras e hilos. Al contacto con el aire se cubre rápidamente con una capa dura y transparente de óxido de aluminio que resiste la posterior acción corrosiva, Es por esto, por lo que los materiales hechos de aluminio no se oxidan. Puede aumentarse su resistencia mediante el anodizado. Consiste en utilizar al aluminio como ánodo en una cuba electrolítica y así se consigue un película muy fina que lo protege de la corrosión. Es difícil de soldar, por la capa de óxido. Para conseguirlo hay que utilizar una pistola de soldadura eléctrica.
APLICACIONES
Por su baja densidad y su conductividad relativamente alta, el aluminio se utiliza como sustituto del cobre en cables de conducción eléctrica de gran longitud. También es utilizado para fabricar utensilios de cocina. Pero como el aluminio puro es muy blando, para la mayoría de usos industriales se alea con otros metales, obteniendo las aleaciones ligeras, que son más duras, tienen mayor resistencia mecánica y facilidad para el mecanizado.
Duraluminio: 95.5% de aluminio y 4.5% de cobre. Se emplea en construcción.
Aluminio-Magnesio: Se utiliza en la industria aeronáutica y naval, en la fabricación de automóviles y bicicletas.
Aluminio-silicio: Se utiliza en la construcción de motores.
Alnico: Níquel, cobalto y aluminio. Se fabrica con él imanes permanentes.
Finalmente, exponemos un vídeo que trata sobre la fabricación con aluminio:
Un metal pesado: el plomo (Pb)

El plomo era conocido en la antigüedad pero se comenzó a utilizar a escala industrial en el s.XIX. La principal mena es la galena, compuesta por sulfuro de plomo, de color gris metálico, blando, pesado y muy frágil.
PROCESO DE OBTENCIÓN
El proceso consta de tres fases: tostación, fusión y afino.
- Tostación: se mezcla con sílice, caliza y material fundente y se calienta en presencia de aire hasta que el sulfuro de plomo se convierte en óxido.
- Fusión: Se introduce en un horno mezclando el óxido de plomo econ coque, caliza fundente y se infla una corriente de aire. El carbón reduce el óxido de plomo y forma plomo metálico impurificado.
- Afino: Se separan los metales que acompañan el plomo. Así se obtiene el plomo bruto, aún parcialmente impurificado.
CARACTERÍSTICAS
Es de color plateado, muy blando, de densidad elevada, baja conductividad eléctrica y térmica, flexible y maleable. Puede ser laminado frío. Se oxida al entrar en contacto con el aire y pierde su brillo característico. Es resistente a la corrosión provocada por los ácidos fuertes pero atacado por la mayoría de los ácidos orgánicos débiles.
APLICACIONES
Su elevada densidad lo hace opaco a las radiaciones electromagnéticas por lo que se usa en instalaciones médicas de radiología y centrales nucleares. Por su comportamiento con los ácidos se utiliza para fabricar recientes que hayan de contenerlos. Se usa en la industria del vidrio como aditivo porque le da mayor peso y dureza. Las aleaciones de plomo y estaño se usan en soldadura blanda. El plomo es un veneno ya que el organismo es incapaz de eliminarlo. La intoxicación de plomo y sus derivados se denomina saturnismo.
Un metal conductor: el cobre (Cu)
 En la naturaleza aparece en diversos minerales, como cuprita, calcopirita y malaquita, pero también puede encontrarse en estado puro.
En la naturaleza aparece en diversos minerales, como cuprita, calcopirita y malaquita, pero también puede encontrarse en estado puro.- Cuprita: Compuesta básicamente por óxido de cobre. Se presenta en masas terrosas de color rojo. Contiene un 88% de riqueza, pero es muy escasa.
- Calcopirita: Sulfuro mixto de hierro y cobre.De color amarillento. Es la principal mena del cobre.
- Malaquita: Mezcla de carbonato y óxido de cobre. Se presenta en masa cristalinas de color azul y es muy buena mena de cobre.
- Cobre puro: Es un metal pardo rojizo. Escaso y suele encontrarse en el fondo de algunos yacimientos de otros minerales de cobre.
Ver artículos en Wikipedia y en la enciclopedia Encarta.
Información sobre sus propiedades y sus aplicaciones en la web
del Centro Español de Información del Cobre
y en www.elcobre.com
PROCESO DE OBTENCIÓN
Se utilizan dos técnicas (la vía húmeda y la vía seca) dependiendo de la riqueza de los minerales empleados. La vía húmeda se emplea cuando el contenido en cobre es bajo (3% y el 10% de riqueza). Se trata de disolver el material con ácido sulfúrico y después aplicar electólisis para recuperar el cobre. La vía seca sólo se puede utilizar si la riqueza del mineral supera el 10%. Es el más utilizado.
Obtención del cobre por vía seca: Se tritura y muele el mineral para reducirlo a polvo. A continuación se introduce en la cámara de flotación en la que el cobre se concentra en la superficie y la ganga se hunde. Después se somete a un proceso de tostación para eliminar el azufre y formar óxidos de hierro y de cobre. El óxido de cobre se intoduce en un horno de reverbero para cocinarlo y eliminar las impurezas. El sulfuro de cobre se somete a un proceso de reducción y se obtiene el cobre bruto mezclado con algo de óxido de cobre.
AFINO
Se lleva a cabo en dos fases: la fase térmica y la fase electrolítica. En la fase térmica el cobre bruto se introduce en hornos de afino en los que se reduce el óxido de cobre residual, mediante gas natural. El cobre que sale del convertidor se vierte en moldes especiales para obtener planchas que serán utilizados como ánodo en la cuba electrolítica. En la fase electrolítica se produce el afino final. El ánodo procede de los moldes de la fase anterior y el cátodo está formado por planchas de cobre puro. De este modo se consigue cobre electolítico con una pureza superior el 99,85%.
CARACTERÍSTICAS Y APLICACIONES
El cobre es un metal de color rojizo, relativamente blando, de conductividad eléctrica y térmica muy elevada, dúctil y maleable. Su elevada conductividad eléctica y su ductilidad lo hacen indicado para la fabricación de cables eléctricos y bobinados. Como el agua y el aire no lo atacan a ninguna temperatura se suele utilizar para fabricar tubos y calderas. Es poco resistente a los agentes atmosféricos, se recubre de una capa de carbonato llamada cardenillo que la protege de la oxidación posterior. Es medianamente resistente a la agresión de los ácidos.
ALEACIONES DE COBRE
El cobre puro es blando, por eso se alea con el aluminio (bronce de aluminio), el cinc (latones), el estaño (bronces) y con otros metales para mejorar su dureza y resistencia a la tracción.
Bronce de aluminio: Está compuesto pòr un 90% de cobre y un 10% de aluminio. Aumenta la dureza del cobre y es mucho más resistente a la corrosión. Por su resistencia a los agresivos atmosféricos se utiliza en la industria para fabricar equipos expuestos a líquidos corrosivos.
Latones: Aleación de cobre con cinc. Es menos resistente que el cobre, pero soporta mejor el agua y el vapor. Se emplea para fabricar casquillos de ajuste de piezas mecánicas. Las aleaciones de cobre y cinc están normalizadas y se añaden nuevos metales que mejoran sus propiedades:
- Si se aumenta el porcentaje de cobre aumenta la moldeabilidad.
- Añadiendo a la aleación azufre y aluminio se mejora su resistencia a la corrosión marina.
- Al añadir plomo mejora su capacidad de mecanizado.
Finalmente, exponemos un vídeo que trata sobre la fabricación con el cobre:
Los metales no férricos
- facilidad de corrosión
- punto de fusión elevado
- baja conductividad térmica y eléctrica
- dificultad de mecanizado
- Metales PESADOS: Cobre, Plomo, Estaño, Cinc, Níquel, Cromo
- Metales LIGEROS: Aluminio, Titanio
- Metales ULTRALIGEROS: Magnesio
Pero los metales no férricos resultan más caros de obtener porque:
- la concentración de algunos de estos metales en sus menas suele ser baja,
- su proceso de obtención consume mucha energía,
- tienen una demanda reducida.
Los metales no férricos de mayor aplicación son el cobre y sus aleaciones. Los demás casi nunca se emplean en estado puro sino en aleaciones.
3 de diciembre de 2008
Reciclado del acero
Los metales férricos (III): tipos de aceros
Dentro de la familia de los aceros existen básicamente tres tipos:
- Aceros martensíticos: Admiten el temple, son magnéticos y fácilmente mecanizables. Su contenido de cromo es de 13 a 17 % y de níquel de 0 a 2 %. Cuando están templados resisten mejor la corrosión.
- Aceros ferríticos: No admiten el temple y son sólo débilmente magnéticos (o no lo son). Su composición es básicamente de hierro y cromo (el contenido de Cr puede llegar al 27 %).
- Aceros austeníticos: Son aceros al cromo-níquel, no son magnéticos y son los que mejor resisten la oxidación y corrosión.
2 de diciembre de 2008
Los metales férricos (II): la industria siderúrgica

Haz clic sobre la imagen de la derecha para ver con más detalle la lámina publicada por AULA 2 (El Mundo) acerca de los altos hornos:
Y veamos también, con los siguientes enlaces, algunas excelentes presentaciones sobre el proceso de fabricación de los metales férricos, fundamentalmente los aceros.
La primera procede de la web de APTA (Asociación para la Promoción Técnica del Acero):
La segunda presentación interesante la encontramos en la web del fabricante CELSA.
También hay una presentación general del acero en la web de UNESID.
Un vídeo de la serie Así se hace (Discovery Channel):
Otro vídeo más:
Los metales férricos (I)
Los metales férricos se pueden clasificar en tres grandes grupos:
- Hierro dulce, con un porcentaje de carbono de menos del 0.1 %
- Aceros, con un porcentaje de carbono del 0.1 – 2.11 %
- Fundiciones, con un porcentaje de carbono del 2.11 – 6.67 %
A mayor porcentaje de carbono mayor dureza, pero también mayor fragilidad (aunque con la combinación de otros elementos se puede conseguir una fragilidad baja con un porcentaje de carbono alto). El níquel confiere dureza y el cromo también, pero además este último evita la corrosión.
El hierro se obtiene de diferentes minerales: magnetita, hematites, siderita... La presencia del hierro en estos minerales suele ser en forma de óxidos. Propiedades: color blanco, elevada densidad, baja dureza, material magnético, baja conductividad eléctrica.
Los aceros se obtienen del arrabio (hierro purificado por fusión del mineral de hierro en alto horno), tras eliminar al máximo las impurezas y reducir el porcentaje de carbono. Propiedades: elevada resistencia a compresión y tracción, elevada dureza, alta resistencia al desgaste; elevada ductilidad.
Debido a sus propiedades, las fundiciones suelen utilizarse para la realización de bloques, bancadas de máquinas, herramientas, soportes, bloques de motores, cuerpos de bombas etc. Las fundiciones no son buenas conductoras de la electricidad y el calor. Propiedades: alta resistencia a la compresión y baja resistencia a la tracción; buena resistencia a las vibraciones, frágil, moldeable en caliente (fundido); resistencia al desgaste.
Para mejorar sus propiedades, los metales férricos admiten diferentes tratamientos:
- Térmicos: recocido, temple y revenido.
- Termoquímicos: cementación, cianuración, nitruración, carbonitruración y sulfurización.
- Mecánicos: laminación en frío, deformación profunda, deformación superficial, laminación en caliente y forja.
- Superficiales: cromado duro y metalización.
28 de noviembre de 2008
Reciclado del vidrio
Desde la entrada en vigor de la Ley de Envases en 1998, todos los envasadores tienen obligación de financiar y poner en funcionamiento un sistema de recogida selectiva –y reciclado- de los envases que ponen en el mercado. Esta obligación legal se puede cumplir bien individualmente – sistema de depósito, devolución y retorno - o colectivamente, a través de un sistema integrado de gestión.
De aquí surge la asociación Ecovidrio, que está encargada de la gestión del reciclado de los residuos de envases de vidrio en toda España (ver su presentación acerca de la cadena de reciclado y clic también en http://www.reciclavidrio.com/)
27 de noviembre de 2008
El vidrio
.png) En AULA 2 (EL MUNDO) hemos encontrado una lámina que resume gráficamente el mundo del vidrio: fabricación, usos, reciclaje...
En AULA 2 (EL MUNDO) hemos encontrado una lámina que resume gráficamente el mundo del vidrio: fabricación, usos, reciclaje...En la web del fabricante SAINT GOBAIN se puede ver una presentación sobre la fabricación del vidrio y sus procesos de transformación.
Otro fabricante, VIDRALA, ha elaborado una estupenda presentación sobre la fabricación de envases de vidrio:
Y en You Tube hemos encontrado otro vídeo de la serie Así se hace (Discovery Channel):
El ladrillo cerámico (vídeos)
El segundo es un vídeo promocional de un fabricante argentino. Dejando a un lado los aspectos publicitarios, el contenido refleja con mucho detalle el proceso de fabricación. Para verlo hay que ir a esta página de You Tube.
Por último, un reportaje de EL MUNDO que combina el aspecto explicativo del proceso industrial con los comentarios acerca de la actual crisis del sector de la construcción.
El ladrillo cerámico
Historia del ladrillo: clic aquí
Proceso de fabricación: clic aquí
.png)
.png)
.png)
¿Qué material es mejor, cerámico o metálico?
Tres razones fundamentales pueden ser esgrimidas para justificar la creciente importancia de los materiales cerámicos:
- Independencia productiva. Un eventual bloqueo en el suministro de algunos metales estratégicos (tales como el niobio, manganeso, cromo, cobalto, níquel…) a los países que no los producen tendría graves consecuencias en sus economías. Veamos como ejemplo el caso del cromo. Es el aditivo más ampliamente utilizado para endurecer, incrementar la resistencia al desgaste y a la corrosión de una gran variedad de aleaciones metálicas. También es utilizado como aditivo que incrementa la resistencia mecánica a la deformación y a la oxidación de muchas aleaciones metálicas a altas temperaturas. Se usa en los aceros inoxidables, en las aleaciones para herramientas y en las superaleaciones. Sin embargo la práctica totalidad de los depósitos mundiales de este mineral se encuentran concentrados en sólo siete países: Sudáfrica, Zimbabwe, Turquía, Kazajstán, India, Cuba y Filipinas. Se intuye claramente la necesidad de buscar materiales alternativos que no requieran la presencia de estos minerales para su fabricación. En este punto los materiales cerámicos pueden desempeñar un papel importante de sustitución, contribuyendo significativamente a reducir la vulnerabilidad de muchas economías nacionales.
- Ahorro energético. El consumo energético para producir un material cerámico es, en general, aproximadamente el 50 % del necesario para producir un metal o un componente metálico. Por otro lado, la mayoría de los materiales cerámicos están constituidos por elementos ampliamente existentes en la corteza terrestre y, generalmente, bastante bien distribuidos. El silicio y el aluminio, dos los componentes más representativos de los materiales cerámicos, son los elementos más abundantes de la corteza terrestre; e incluso el circonio, constituyente fundamental de gran parte de los materiales cerámicos avanzados, abunda más que metales tan comunes como el cobre, el plomo o el cinc.
- Mejora de propiedades. Los materiales cerámicos presentan ventajas intrínsecas a su naturaleza, en cuanto a sus propiedades: elevada dureza, mayor resistencia a la oxidación, menor densidad, inferior conductividad térmica, superior resistencia al ataque químico y por supuesto una excelente resistencia a temperaturas elevadas.
Frente a las ventajas mencionadas, los materiales cerámicos presentan algunos inconvenientes. Estos son fundamentalmente: su reproducibilidad y su fragilidad, condición inherente a su naturaleza. Sin embargo, estas desventajas pueden ser superadas en alguna medida mediante una adecuada elección de las materias primas y modificando convenientemente el proceso de fabricación. La reproducibilidad se puede mejorar mediante un procesado adecuado, con objeto de lograr micro-estructuras controladas con tamaños de defectos lo más pequeños posibles. Y la fragilidad tratando de incrementar, con mecanismos de reforzamiento adecuados, la energía requerida para que una grieta se propague en el material.
Cerámica tradicional y cerámica técnica
Si bien la utilidad de los materiales cerámicos para las utilidades a las que estamos acostumbrados sigue plenamente vigente, el progreso generado con los nuevos usos ha abierto una brecha entre las propiedades requeridas. Por eso podemos hablar de cerámica tradicional y cerámica técnica o avanzada, cuyas principales diferencias vemos en el gráfico de la derecha.


26 de noviembre de 2008
La cerámica
.png)
Haz clic sobre la imagen de la derecha para saber algo más sobre la materia prima de la cerámica: el barro (Ficha de AULA 2 - El Mundo)
Proceso de fabricación: clic aquí
Por último, un vídeo sobre la fabricación de objetos de porcelana:
25 de noviembre de 2008
Materiales en KALIPEDIA
El asfalto (II)
Impermeabilizar la estructura del pavimento, haciéndolo poco sensible a la humedad y eficaz contra la penetración del agua de lluvia.
Unir y cohesionar los áridos, resistiendo la acción mecánica de disgregación producida por las cargas de los vehículos. Igualmente mejora la capacidad portante de la estructura, permitiendo disminuir su espesor.
- Proporcionar una estructura de pavimento con características flexibles que permiten cierto grado de acomodo, sin fisurarse, a eventuales movimientos de las capas subyacentes.
Para aprender sobre la historia del asfalto: clic aquí
Para averiguar cómo se fabrican y aplican las mezclas bituminosas: clic aquí
Para saber más sobre la aplicación del asfalto en carreteras: clic aquí
Para conocer cómo funciona la maquinaria que fabrica las mezclas bituminosas: clic aquí
El asfalto (I): aglomerantes bituminosos
El siguiente vídeo de Discovery Channel da una buena idea acerca de este material (nota: cuando menciona cemento asfáltico se refiere al asfalto como aglomerante):
El yeso
- Es un buen aislante térmico: debido a su gran inercia térmica y su bajo coeficiente de conductividad, reduce los puente térmicos y elimina el fenómeno de pared fría.
- Es un buen aislante acústico: tiene cierta elasticidad, lo que unido a su estructura interna finamente porosa hacen que se comporte como buen absorbente acústico, disminuyendo reverberaciones y amortiguando las ondas sonoras.
- Regula la humedad ambiente: los revestimientos de yeso absorben el exceso de humedad ambiental, para restituirla cuando el aire está más seco.
- Protege en caso de incendio: el yeso es incombustible y desempeña un papel activo en presencia del fuego, ya que absorbe una considerable cantidad de calor gracias a la evaporación del agua de cristalización. Por eso prolonga la resistencia al fuego de las estructuras sobre las cuales se aplica. Además, no despide vapores tóxicos ni humos.
La cal (I)
24 de noviembre de 2008
El hormigón (II): vídeos
Vídeo sobre la producción de prefabricados de hormigón (tubos para el alcantarillado):
El hormigón (I)
Los morteros (II)
Los morteros (I)
En construcción, se llama mortero a la mezcla de un aglomerante hidráulico (cemento o cal) con un árido fino y agua. Generalmente se utiliza en obras de albañilería, como:
- material de agarre para colocar ladrillos (foto), bloques y baldosas
- revestimiento de paredes
- capa superficial de soleras de hormigón

Hay varias formas de preparación del mortero para su utilización en las obras:
- elaboración a pie de obra, mezclando todos los componentes (recibidos por separado) en el momento en que se necesite. Es la manera más habitual de prepararlo cuando se trata de pequeñas cantidades.
- elaboración de mortero húmedo en una planta industrial, que lo transporta a la obra ya amasado y listo para su uso. Es la alternativa más apropiada para el uso ocasional de una gran cantidad de mortero.
- elaboración de mortero seco en una planta industrial, que suministra a la obra un silo de almacenaje que contiene el aglomerante y el árido para proceder a su mezcla y amasado con agua cuando sea preciso. Es la opción más adecuada para el uso continuado de grandes cantidades de mortero.
El cemento (III)
- HOLCIM (clic aquí). La presentación se inicia con una panorámica de una fábrica de cemento: al desplazar el ratón sobre la imagen aparecen pequeños rótulos que te indican qué parte de la instalación estás señalando. Luego abre el Menú y selecciona las distintas fases del proceso para ver una secuencia explicativa.
- Cementos LA UNION:(clic aquí). Mueve el ratón sobre los rótulos para ver imágenes relacionadas con cada fase del proceso.
El cemento (II)
El cemento (I)
Al mezclarse con agua, el cemento forma una pasta que adquiere una elevada resistencia mecánica. Esto le convierte en el conglomerante por excelencia para elaborar morteros (empleados para revestir fachadas y para unir piezas de obras de fábrica, tales como ladrillos y bloques) y hormigones (usados para construir estructuras y elaborar productos prefabricados, como son las baldosas, bordillos, bloques y tubos).
En la web de IECA (Instituto Español del Cemento y sus Aplicaciones) hay abundante información sobre el cemento. Y en la siguiente presentación, realizada por Corporación Noroeste (Grupo CIMPOR) en http://www.corpnor.es/, se muestra el proceso de fabricación del cemento:
23 de noviembre de 2008
Los ligantes en la Construcción
La clasificación más habitual es la siguiente:
- Conglomerantes aéreos: son aquellos que sólo pueden endurecer en contacto con el aire
- Conglomerantes hidráulicos: son los que indistintamente pueden endurecer en
contacto con el aire y sumergidos en agua - Aglomerantes hidrocarbonados: son productos procedentes de la destilación del petróleo (asfalto) o del carbón (alquitrán) y que contienen betún (por ello suelen denominarse ligantes bituminosos)
Los ligantes se caracterizan principalmente por su:
- plasticidad: en combinación con el agua (aéreos e hidráulicos) o por acción del calor (bituminosos) forman pastas de consistencia plástica
- moldeabilidad: rellenan con facilidad el espacio que los contiene (encofrados y moldes)
- resistencia: al endurecer desarrollan una apreciable resistencia mecánica
Se llama pasta al conjunto de conglomerante más agua, mezclados homogéneamente mediante el amasado. Los morteros son una mezcla de pasta con áridos finos (tamaño del grano inferior a 5 mm) y los hormigones son una mezcla de pasta con áridos finos y gruesos (tamaño del grano superior a 5 mm).
21 de noviembre de 2008
Extracción de áridos y Medio Ambiente
Los problemas medioambientales provocados por la extracción de áridos frecuentemente se producen en las llamadas graveras (explotaciones en entornos fluviales), como ilustra el siguiente vídeo:
Cuando se deja de explotar un yacimiento, es preciso proceder a su restauración, como se explica en este otro vídeo:
Otro vídeo más, que denuncia las acciones más agresivas con el medio ambiente:
Los áridos
Y en la siguiente presentación, realizada por Corporación Noroeste (Grupo CIMPOR) en http://www.corpnor.es/, se muestra el proceso de fabricación de los áridos artificiales o de cantera:
También es interesante el siguiente vídeo, que muestra una instalación sencilla, de las más habituales para producir áridos:
Los materiales pétreos
Veamos otro vídeo que ilustra una técnica de gran precisión para el corte de mármoles, granitos, etc (también sirve para cortar metales, plásticos...): el corte con chorro de agua a alta presión
Clasificación de materiales: metales y no metales
– Materiales metálicos. El concepto de metal se refiere tanto a elementos puros (por ejemplo Fe, Cu, Al, Mg, Ni, Ti, Pb, Sn, Zn) como a las aleaciones con características metálicas (como el acero, el bronce y el latón). Se caracterizan por lo siguiente:
- poseen buena conductividad térmica y eléctrica
- tienen un brillo característico, llamado metálico
- son dúctiles o deformables
- están formados por moléculas monoatómicas
- son muy poco reactivos con el hidrógeno
- se combinan con el oxígeno para formar los óxidos
- tienen una densidad elevada y son sólidos a temperatura normal (excepto el mercurio, que es líquido)
– Materiales no metálicos. Por exclusión, se denominan no metálicos a los materiales que no reúnen las propiedades de los metales. La mayoría de los elementos químicos conocidos son metales, sólo 17 son no metales y 8 son metaloides. Esta categoría incluye a los compuestos orgánicos y muchos inorgánicos (óxidos, sales...), y materiales tan distintos como la madera, la cerámica, el hormigón, el vidrio, el caucho, los plásticos... Los no metales se distinguen por:
- poseen un amplio rango de propiedades
- en comparación con los metales, son menos dúctiles, menos resistentes, menos densos, aislantes, no magnéticos
- muchos de ellos son inertes (no reaccionan químicamente)
19 de noviembre de 2008
Clasificación de materiales: sólidos cristalinos y amorfos
- Sustancias cristalinas: los átomos se unen entre sí mediante una perfecta ordenación geométrica, formando estructuras tridimensionales periódicas ó cristales. En esta forma encontramos elementos como el hierro (Fe), el diamante y el grafito (variedades del carbono, C), y compuestos tales como la sal común (cloruro sódico, ClNa) y el carbonato cálcico (CaCO3).
- Sustancias vítreas o amorfas: los átomos no siguen un patrón regular y repetitivo. Es el caso del vidrio y de muchos materiales plásticos.


¿Cómo se forman las sustancias cristalinas?
Pincha en el texto de la izquierda para averiguarlo.

¿Qué son los minerales?
En el texto que aparece a la derecha puedes aprender sobre ellos.
18 de noviembre de 2008
Los estados de agregación de la materia
- haz clic en esta página para revisar tus conocimientos sobre sólidos, líquidos y gases...
- haz clic en esta otra para profundizar algo más sobre los estados de agregación...







